Pengertian Perubahan Fisika
Perubahan fisika adalah perubahan pada mataeri yang tidak menghasilkan zat baru. Sedangkan perubahan kimia adalah perubahan pada materi yang menghasilkan zat baru. Contoh perubahan fisika, diantaranya adalah es mencair dan kamper menguap.
Mungkin di daerahmu
terdapat sungai yang memiliki batuan dari berbagai ukuran. Batuan tersebut ada
yang besar, ada pula yang kecil. Arus sungai yang deras menerpa dan
menghanyutkan batuan tersebut sehingga pecah menjadi batuan-batuan yang lebih
kecil. Pecahan-pecahan batuan ini memiliki sifat yang sama dengan batuan
semula. Sebagai contoh, pecahan batuan dan batuan semula tetap keras, serta
bahan penyusunnya pun sama. Peristiwa pecahnya batuan tergolong perubahan
fisika.
Ketika anda menjemur pakaian juga terjadi perubahan fisika. Pakaian yang semula basah lama-kelamaan kering karena mendapat panas matahari. Panas matahari menguapkan air yang terdapat pada pakaian. Perubahan dari air menjadi uap air tergolong perubahan fisika.
Ketika kita membuat minuman teh juga terjadi perubahan fisika. Pada saat itu kita mencampur gula dengan air teh. Setelah diaduk beberapa lama, butiran gula menghilang dan timbul rasa manis. Adanya rasa manis menunjukkan bahwa zat gula sebenarnya tidak hilang, melainkan masih terdapat dalam air teh.
Perubahan fisika juga dapat diamati ketika kita merebus air, membuat es batu, air mengalami perubahan wujud dari cairan menjadi padatan. Ketika kita menggoreng masakan dengan margarine, terjadi perubahan wujud dari padatan menjadi cairan.
Ketika anda menjemur pakaian juga terjadi perubahan fisika. Pakaian yang semula basah lama-kelamaan kering karena mendapat panas matahari. Panas matahari menguapkan air yang terdapat pada pakaian. Perubahan dari air menjadi uap air tergolong perubahan fisika.
Ketika kita membuat minuman teh juga terjadi perubahan fisika. Pada saat itu kita mencampur gula dengan air teh. Setelah diaduk beberapa lama, butiran gula menghilang dan timbul rasa manis. Adanya rasa manis menunjukkan bahwa zat gula sebenarnya tidak hilang, melainkan masih terdapat dalam air teh.
Perubahan fisika juga dapat diamati ketika kita merebus air, membuat es batu, air mengalami perubahan wujud dari cairan menjadi padatan. Ketika kita menggoreng masakan dengan margarine, terjadi perubahan wujud dari padatan menjadi cairan.
Jenis-Jenis Perubahan Fisika
Jenis-jenis perubahan fisika dapat diamati melalui perubahan wujud zat. Perubahan wujud mencakup perubahan dari padat ke cair (mencair atau meleleh), cair ke gas (menguap), gas ke cair (mengembun), cair ke padat (membeku), dan padat ke gas (menyublim). Semua perubahan wujud ini terjadi karena benda menerima atau melepaskan panas.Mencair (misalnya, es menjadi air), menguap (air menjadi uap air), dan menyublim (kapur barus menjadi gas) terjadi karena benda menerima panas. Sebaliknya, membeku (air menjadi es batu) dan mengembun (uap air menjadi air) terjadi karena benda melepaskan panas.
Pencampuran tergolong perubahan fisika selama benda-benda yang bercampur tidak bereaksi. Contohnya : mencampur gula dengan air, mencampur pasir dengan gula, dan mencampur serbuk besi dengan serbuk belerang. Benda-benda yang bercampur ini masih dapat dipisahkan satu sama lain.
Namun bila pada pencampuran tersebut timbul suatu reaksi kimia maka tergolong perubahan kimia. Contohnya : magnesium dicampur dengan asam klorida menghasilkan magnesium klorida dan gas hidrogen, serta natrium dicampur dengan air menghasilkan natrium hidroksida dan gas hidrogen.
Memecahkan atau membelah benda juga tergolong perubahan fisika. Contohnya : membelah kayu dan memotong kertas. Pada perubahan tersebut tidak terbentuk zat yang baru. Kayu semula memiliki sifat yang sama dengan kayu yang sudah dibelah. Demikian pula, kertas semula memiliki sifat yang sama dengan kertas yang sudah dipotong.Walaupun wujud dari es dan kamper pada contoh di atas berubah wujudnya, namun senyawa atau materi yang menyusunnya tidak berubah sama sekali.
Suatu zat dapat berubah karena ada pengaruh energi pada zat tersebut. Suatu zat padat dapat berubah menjadi zat cair atau gas, zat cair dapat berubah menjadi zat padat atau gas, dan zatgas dapat berubah menjadi zat cair atau padat, tetapi sifat zat itu masih tetap. Mari kita simak beberapa perubahan wujud zat tesebut, berdasarkan segitiga perubahan wujud zat pada gambar berikut:
1) Mencair
Mencair
dikenal juga dengan meleleh. Apa yang terjadi jika pada zat padat ketika
ditambahkan energi, misal dengan cara dipanaskan? Contohnya, es batu
dipanaskan. Tentunya, energi zat padat tersebut akan bertambah besar, jarak
antar molekul zat akan semakin renggang sehingga gerakan partikelnya semakin
cepat. Jika diteruskan pemanasan sampai suhu tertentu, partikel menjadi
bergerak tidak teratur, bebas bergerak, dan wujud padat akan berubah menjadi
wujud cair. Perubahan wujud dari zat padat menjadi zat cair dinamakan mencair
atau meleleh. Titik pada saat zat padat berubah menjadi zat cair dinamakan
titik lebur. Gambar berikut ini menunjukkan perubahan susunan partikel zat padat menjadi
zat cair.
2) Menguap
Ketika
suatu zat cair dipanaskan, partikel zat cair akan menyerap energi. Energi
kinetiknya bertambah sehingga gerakannya makin kencang. Pada saat mendapatkan
energi pada temperatur tertentu, partikel zat cair bergerak bebas, berubah
wujud menjadi gas.
Di permukaan, zat cair
bergerak ke atas dengan kecepatan tinggi dan tidak beraturan, perubahan wujud
dan pergerakan gas ini dinamakan mendidih. Sedangkan perubahan wujud dari cair
menjadi gas dinamakan menguap.Temperatur
pada saat zat cair dipanaskan berubah menjadi wujud gas dinamakan titik didih. Gambar berikut ini menunjukkan perubahan susunan partikel zat cair menjadi
zat gas.
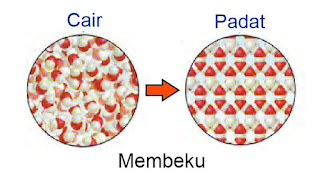
3) Membeku
Apa
yang terjadi jika zat cair didinginkan? Artinya, energinya dikurangi. Energinya
akan menurun dan gerakan partikelnya makin lambat. Jika temperatur terus
diturunkan, partikel terus kehilangan energinya sehingga makin lambat dan makin
mendekat. Pada suhu tertentu, partikel kehilangan energinya, gerakannya hanya
bervibrasi di tempat, dan merapat satu sama lain. Wujud zat berubah dari cair
menjadi padat. Perubahan
susunan dan gerakan partikel ini dinamakan membeku. Temperatur pada saat wujud
zat cair berubah menjadi wujud padat dinamakan titik beku. Gambar berikut ini menunjukkan perubahan susunan partikel zat cair menjadi
zat padat.
4) Mengembun
Jika
uap didinginkan, maka pergerakan partikelnya menjadi lambat dan saling
mendekat, seperti keadaan partikel zat cair. Perubahan
gas menjadi zat cair tersebut dinamakan mengembun. Gambar berikut ini menunjukkan perubahan susunan partikel zat gas menjadi
zat cair.
5) Menyublim
Jika
kita meletakkan kamper dalam lemari pakaian, maka makin lama ukuran kamper
tersebut makin kecil dan lemari akan menjadi harum wangi kamper. Kamper
merupakan jenis zat padat yang dapat berubah langsung menjadi gas tanpa melalui
wujud cair; perubahan zat ini dinamakan menyublim atau sublimasi. Gambar berikut ini menunjukkan perubahan susunan partikel zat padat menjadi
zat gas.
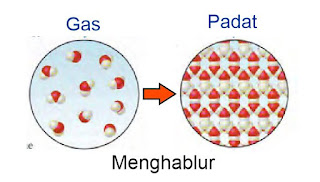
6) Mendeposisi/ Menghablur
Mendeposisi/ menghablur atau
hablur adalah kebalikan dari menyublim, yaitu perubahan suatu benda/zat dari
gas menjadi benda padat. Menghablur di sebut juga mengkristal atau desposisi. Gambar berikut ini menunjukkan perubahan susunan partikel zat padat menjadi
zat gas.
Sedangkan contoh menghablur
yaitu pada pembuatan es kering yaitu dengan cara “memasukkan” karbondioksida ke
ruangan yang bertekanan tinggi. Pada saat tekanan dikeluarkan, karbondioksida
itu akan berubah menjadi butir-butir padat yang menjadi dry ice alias es
kering. Es kering biasa digunakan oleh penjual es keliling untuk mempertahankan
suhu pada penyimpanan es krim, warnanya putih bersih.